老化介入・老化制御
摂取カロリーと老化
カロリー制限はヒトの老化を遅らせるか
ネズミや他の実験動物ではカロリー制限は老化を遅らせたり、寿命を延ばしたりする作用があること分かっていますが、人間ではどうでしょうか。 ヒトで何十年にもわたってカロリー制限を行って老化や寿命に対する影響を調べることは現実的ではありません。
ラットの研究でよくおこなわれる若齢期から生涯にわたるカロリー制限をヒトで行おうとすると、小中学校時代から何十年にもわたって制限しなくてはなりませんから、そういう"実験"は不可能です。マウスやラットでは中齢期(中年)から制限しても、ある程度の寿命延長や抗老化作用があることが分かっていますが、ヒトで行う場合、長期間カロリーだけを減らしてビタミンやミネラルその他の栄養素が不足しないようにするのは簡単ではありません。
人口の3分の1が肥満(BMI(体格指数)30以上)といわれる肥満大国アメリカではカロリー制限に対する関心が高く幾つかの研究施設(国立老化研究所National Institute on Aging (NIA), Baltimoreやウィスコンシン大学 (University of Wisconsin, UW)のWisconsin National Primate Research Centerなど)で寿命がヒトの3分の1程度で進化的にヒトに近い霊長類であるアカゲザルを使った研究が 30年ほど前から行われています。 研究室で飼育されたアカゲザルの平均寿命は約27年、最長寿命は約40年と考えられています。
以下に解説するアカゲザルのカロリー制限研究は、NIAで1987年、UWで1989年に開始されました。両研究とも途中で追加されたものも含めて100匹前後の個体が使われています。
1.サルのカロリー制限実験
1-1.ウィスコンシン大学(WU)の研究報告(2009年)
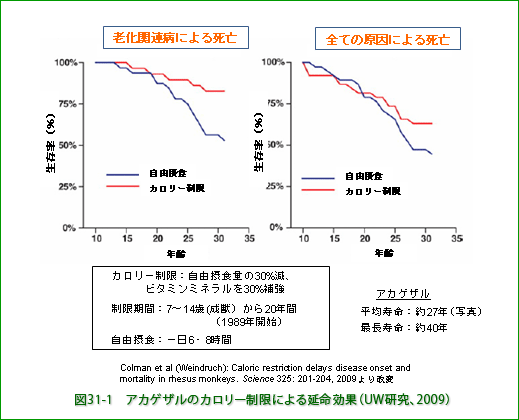
UW研究ではカロリー制限開始時に7歳から15歳だったサルは、この報告の時点までにかなりの数が老年病その他の原因で死亡しています。久しく待たれていた寿命に対する影響のデータが2009年に発表されました。自由に餌を食べてきたグループ(自由摂食群)で50%が生存している時点で、カロリー制限をしてきたグループ(制限群)では80%が生存していたということです。自由に餌を食べるといっても食餌を与えられるのは一日6時間から8時間。自由摂食の30%減の食餌を与えられる制限群ではビタミンやミネラルを30%増にされています。
なお、正確に言うと、両群の生存率の違いは加齢関連疾患(がん・心血管疾患・糖代謝異常)による死亡のみを取り出した場合に見られるもので全ての死亡原因でみると違いは見られなくなります(図31−1)。 このグラフを延長して推定すると制限群では最長寿命の延長も見られるかもしれません。ネズミ並に延長すれば最終結果が出るまでにはさらに15年か20年かかるでしょう。
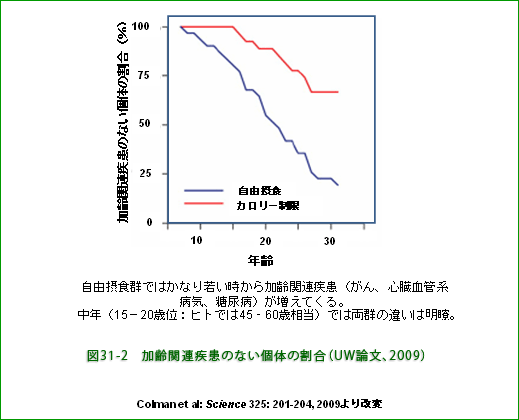
生存個体について加齢関連疾患にかかっていない個体の割合をみると、自由摂食群の平均寿命(約27歳)の年齢で、制限群で約70%、自由摂食群で約20%でした。 この比較でもカロリー制限による明らかな有益効果が見られます(図31−2)。 自由摂食では、かなり若い時から加齢関連疾患が増加し始める点で飽食時代のヒトの場合と似ています。 論文の著者はカロリー制限群では"見かけ"も若々しいと言っていますが、制限サルは確かに色つやが良く、より生き生きと精悍に見えます(図31−3)。

なお、2012年に発表されたアメリカの国立老化研究所(NIA)の報告(次項1−2参照)を受けて、2014年にUWグループから、カロリー制限群で寿命延長効果が確認されたという新たな論文が発表されています(Coleman RJ et al. Nature Comm. DOI: 10.1038, 1 April, 2014)。
1-2. アメリカの国立老化研究所(NIA)の報告(2012年)
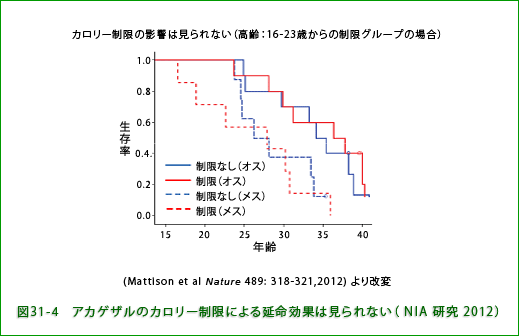
上述のUWの研究グループの報告(Colman RJ et al. Science 325: 201-204, 2009)に続いてアメリカの国立老化研究所(National Institute on Aging, NIA)から同じアカゲザルを使った長期カロリー制限研究の結果が報告されました(Mattison et al. Nature 489: 318- 321, 2012 )。それによると、UWグループの結果と違って寿命延長は見られなかったという結論でした。両研究で使われたのはともにアカゲザルでしたが、NIA研究ではカロリー制限は1,2歳の若齢から始めた群から15歳ー26歳の高齢から始めた群まで幅広い年齢層のサルが使われたのに対してUW研究では上述のように7歳から15歳のものについて制限を行っています。したがって、制限を始めた年齢の違いが結果に影響している可能性がありますが、NIA研究では若齢で始めたものも高齢で始めたものも制限をしなかった対照群と比較して生存率の違いはみられませんでした(図31-4に高齢で制限を開始したグループの結果を示します)。
UW研究はScience、NIA研究はNatureという、ともにトップのクラス著名な学術誌に報告されたこともあり、老化研究者の間に議論を巻き起こしました (例えばMaxmen A: Nature 488:569, 2012; Bourzac K: Nature 492: S18-20, 2012; Austad S: Nature 489: 210-211, 2012) 。
ネズミでもサルでも長期カロリー制限の研究では、カロリー摂取量を自由摂食(標準摂食)の場合よりも30~40%減らすのが一般的ですが、カロリーは同じでもエサの内容や与え方などは異なっているのが普通です。上記両研究ではアカゲザルを使って、ともに30%のカロリー制限をしています。両研究の主な違いは、以下のように食餌の内容と投与方法です。
1.UW研究では成分の点でより調節しやすい半精製材料を使い、NIAの方は天然の食材を使っています。NIA研究で使われた天然食材には品質のバラツキがあり得ますが、植物成分やミネラルなどの微量金属その他の成分が含まれているためそれが健康状態に影響する可能性があります。一方、半精製材料を使ったUW研究では、不足する可能性があるビタミンやミネラルを別に補充しています。
2.タンパク質源として、NIA研究では多様な食材(小麦・トウモロコシ・大豆・サカナ・アルファルファ)が使われているのに対し、UW研究ではミルクから精製されたタンパク質ラクトアルブミンが使われています。したがってNIA研究ではこれらの食材中の他の成分の影響が考えられ、UW研究ではタンパク質の種類の偏りの影響があるかもしれません。
3.脂肪分としては、NIA研究ではダイズ油の他、トウモロコシ・小麦・サカナが使われています。よく知られているようにサカナの油には健康にいいと言われる不飽和脂肪酸のオメガ3脂肪酸(EPA: eicosa pentaenoic fatty acidやDHA: docosahexanoic fatty acidなど)が多く含まれています。UW研究では脂肪源としてトウモロコシ油を使っています。なお、オメガ3脂肪酸は植物油にも含まれています。脂肪量(全食事中の重量%)は、NIAが約5%、UWでは約10%でUWの方が約2倍多いことになります。
なお、NIA研究では餌に酸化されやすい不飽和脂肪酸を多く含むため抗酸化作用があるとされるフラボノイド(ポリフェノールの一種)が加えられています。
4.カロリーの多くをしめる炭水化物含量はともに57−61%でほぼ同じですが、NIA研究ではトウモロコシデンプンとショ糖(砂糖、全炭水化物の7%)が使われているのに対して、UW研究の方にはショ糖が全炭水化物の45%含まれていて、ショ糖含量が極めて高いのが特徴です。ショ糖は単糖のブドウ糖と果糖が結合した二糖で、腸で容易に分解されて速やかに吸収される血糖値が上がり易い炭水化物です。一方高分子のデンプンは何段階かの反応で分解されてブドウ糖になって吸収されるため血糖値がショ糖より上がり難い炭水化物です。したがって両研究では糖尿病リスクに違いが出ることが考えられますが、実際、UWのサルの糖尿病発症率は40%、NIAの方は12.5%と報告されています。
5.UWグループのその後の報告(Colman RJ et al. Nature Comm, 5: 3557, 2014)では、両研究の自由摂食群(対照群)はUW研究では何の制限も加えないで食べさせているのに対して、NIA研究では若干の制限が加えられており、この程度の制限でも寿命延長・抗老化効果があり、そのため実験群(より強い制限群)との間に差が生じなかったのではないかと指摘しています。実際、対照群の体重はNIAのサルの方が低くその可能性は否定出来ません(1−3の議論参照)。
6.餌の問題とは別に、両研究で使われているアカゲザルの由来が異なることが結果に影響している可能性も指摘されています。UW研究のサルは全てインド産であるのに対して、 NIAの方はインド産と中国産が混じっています。両者に遺伝的な違いがあり、カロリー制限効果が異なるかもしれません。マウスでは系統によってはカロリー制限による寿命延長が見られないという報告があります。
7.CR実験開始時のサルの年齢は、UW研究では7歳から15歳で成長後にCRを開始していていることになります。NIA研究では成長前の個体を含む1歳から23歳で、成長期にCRを開始しているものと成長後に開始しているものが含まれています。両研究グループで使ったサルの年齢層はかなり異なっていますから、一緒にしてカロリー制限の影響を比較するには無理がありそうです。実際、次項(1−3)で述べる両グループの結果の比較研究論文では、CR開始年齢が異なる集団を別々にCRの影響を評価しています。
8.10年、20年にわたる長期飼育ではサルが種々の病気に罹患する可能性があり、病気になった時の対処の仕方が問題になります。UW研究ではCR開始直後から病気になれば治療してきたのに対して、NIAの方は研究の途中(2010年ころ)から治療を行っています。特にメスの場合は子宮内膜症にかかる割合が高く、合併症で死亡する個体も多いということです(NIA研究の場合:44匹中12匹;UW研究では33匹中2匹が合併症で死亡)。また、総カロリーは同等でもショ糖や脂肪摂取の割合が多いUW研究では、糖尿病前駆状態のインスリン抵抗性になる個体が多く糖尿病への移行を防ぐ治療が施されています。この点では、文明国に住むヒトと同様と言えます。
1-3.ウィスコンシン大学(WU)と国立老化研究所(NIA)の共同論文(2017年)
このようにサルの大規模カロリー制限研究を行ってきたアメリカの両研究施設の報告に食い違い(UW研究では寿命延長・健康増進効果がみられたのに対しNIA研究では健康増進の傾向はみられるが寿命延長効果はなかった)がありました。共同論文ではこの点を一緒に検討したのです。
余談ですが、何年か前の国際老年学会議で旧友のRoth, Ingram両博士(ともにNIA研究を初期から主導してきた研究者)に会った際、あの違いをどう考えるかと尋ねたところ、これから両グループで論文内容を詳細に比較検討する計画だと言っていましたが、それが今回の共同論文になったというわけです(Mattison JA et al. Nature Comm. 8:14063,DOI 10.1038, 17 Jan, 2017)。
この報告は新たな実験に関するものではなく、UW(2009年)とNIA(2012年)の論文の違いを改めて整理し直したものです。その結果、前述の食事内容の違いの他に、両研究で比較対照に用いた動物群の摂食状況は同一とはみなせないということでした。NIA研究の方は非制限とされている対照群にすでに若干の制限がかかっていたというのです。これはNIA論文が発表された当時から指摘されていたことですが、今回両グループが一緒に再検討をして、やはり、そこに問題の一つがありそうだとなったのです。
さらに、上述(1−2の7)のようにCR開始時のサルの年齢構成は同じではありません。NIA研究では1,2歳の極若い個体から20歳を超える個体が使われています。ヒトでいうと幼稚園児や小学校低学年の子供から5,60歳の中高年までが対象になっているといっていいでしょう。一方、UW研究では、7−15歳のサルが使われており、ヒトでは20歳から50歳前くらいにあたります。
摂食(制限)方法についても違いがありました。NIAの自由摂食の対照群は、全く自由に食べていたわけではなく、過食にならない程度に制限されていました。幼若個体では、制約し過ぎることによって成長障害が起こるのを防止するためです。ヒトでいうと、肥満児にならない程度の制限が加えられていたといっていいかもしれません。成長期(8歳頃まで)を過ぎた個体だけを使ったUW研究ではそうした配慮は不要でCR群は研究の初めから自由摂食量の30%減の餌を摂っていました。摂食時間帯も両者では異なっています。さらにUW研究のサルは成長期にどういう食生活をしていたか不明なのでその影響は分かりません。このように両研究で使われたサルの場合、生まれた時から厳密に整備された環境下で飼育されたラットやマウスと違い制御できない要素があるのです。
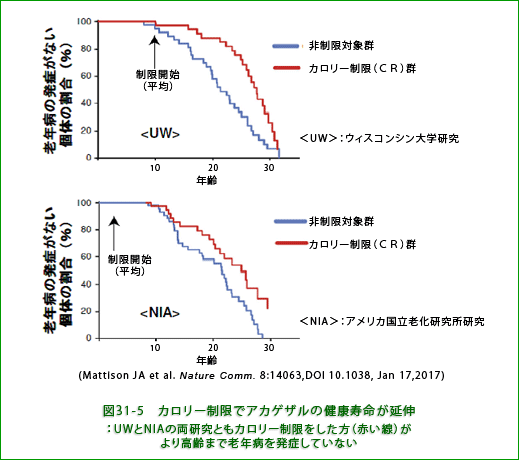
NIA研究で調べられた若齢期からのCRの影響を見るとオスメスとも制限群の方が寿命が短縮していることが注目されます。中間寿命(集団の50%が死亡する年齢)がオスでは対照群28.78歳、制限群(CR) 26.31歳;メスではそれぞれ25.67歳と22.63歳で、明らかにCR群で寿命が短くなっています。なお、ネズミの場合、若齢期から制限した方が寿命延長効果が大きいことが知られています。7ー15歳で制限を開始したUW研究の場合、オスサルでは制限群28.32歳、対照群26.11歳で制限群の寿命が延長しているのが分かります。NIAの高齢サル群では制限群27.87歳、対照群27.19歳で制限によって若干延長してはいますが、UWの場合ほど顕著ではありません。ちょっと苦しい解釈ですが、高齢群だけをみると両研究ともCRで寿命延長がみられ、制限を始める時期が重要だと結論しています。私がみるところでは、幼若期からの制限は寿命を短縮して有害になりうるという点は重要だと思いますが、NIA研究で高齢群のCRに寿命延長効果があると言うのは無理がありそうです(図31-4参照)。むしろ、NIAの対照群ですでに若干の制限がかかっていたため、CR群との間に明瞭な差が生じなかったということが重要ではないかと思います。寿命を伸ばす効果という点では、自由摂食に対して30%という強い制限は必要なく過食でなければいいということかもしれないのです。少なくとも肥満のヒトの割合がアメリカに比べてはるかに少ない日本人の場合に当てはめると、そう考えられます。
重要なのは、図31-5に示すように、両研究ともCRによって加齢関連疾患の発症が遅れているという点です。寿命延長効果のある無しにかかわらず、CR群の方がより高齢まで病気を発症しない、つまり健康寿命が延伸していることを示していると思われます。
なお、ネズミの場合、カロリー制限動物は自由摂食群よりも活発に動き回ることが知られていますが(おそらく餌を探して動き回るため)、サルの場合は報告がないようです。ネズミもアカゲザルもCRによって加齢性筋萎縮(サルコぺニア)が軽減することが分かっていますから、サルの場合もCRで運動が促進し、そのためにサルコペニアが軽減しているのかもしれません。もしそうなら、CRの健康増進効果は、少なくとも実験動物の場合、運動の影響も加味されたものである可能性があります。それに対してヒトの場合は、自ら望んで制限しているので、食べ物を求めて歩き回ったりはしないでしょう。したがって、サルコぺニアはむしろ進行すると考えられます。実際、次項で述べるように(「2.ヒトにおけるカロリー制限研究」参照)、一年間カロリー制限したヒトでは脚の骨格筋に萎縮が起こることが示されています。
2.ヒトにおけるカロリー制限
霊長類のサルでカロリー制限が加齢関連疾患の発症を遅らせて寿命を延ばすようだ、ということになるとヒトではどうかが気になります。 美容や肥満防止のためにダイエットをしている人はかなりいると思いますが、寿命を延ばす目的で取り組んでいる人はあまりいないのではないでしょうか。10年ほど前にカロリー制限研究を行っている老化の専門家が"ヒトでもカロリー制限が寿命を延ばすと思うか"というテーマで誌上討論をやりました (Biogerontology 7: 123-168, 2006; 関連解説記事 Nature 441: 807-809, 2006 )。 “討論”といってもそれぞれが自分の意見を述べただけですが。10名の研究者の約半数はヒトでもカロリー制限に寿命延長効果はあるだろうという意見でした。 私は動物実験ではカロリー制限に抗老化作用が見られているが(「摂取カロリーと老化」 図9、9-3、9-4 および 後藤ほか:後半生における食餌制限の抗老化作用 生体の科学 53: 502-508,2002参照)、成人のヒトの場合は、習慣的にほどほどの食事をしている場合が多いと思われるのでカロリー制限の効果は、過食の場合を除いて、ほとんど期待できないだろうという意見を述べました(Goto S: Biogerontology 7:135-138, 2006)。 柴田博先生(人間科学総合大学大学院名誉教授・元老人総合研究所副所長)は、特に日本人の場合、国民全体の摂取エネルギー量が減少傾向にあり、一般論として現在よりも減らすのは有害だという見解です(解説書:柴田博「病気にならない体はプラス10 kg」(ベスト新書,2008)など)。
ヒトのカロリー制限についてよく知られた"実験"は、かなり過激なカロリー制限研究者であり老化免疫学者でもあったRoy Walford (当時カリフォルニア大学教授、67歳)も加わった"Biosphere 2"実験でしょう(アリング/ネルソン著「バイオスフィア実験生活」(講談社ブルーバックス、1996)。 アリゾナ州(アメリカ)の砂漠地帯に建設されたこの"地球二世号"実験施設は、外界からの食糧その他の補給を一切絶った閉鎖空間で長期間自給自足生活をすることによって、将来の宇宙空間での生活のシミュレーションしようという試みでした(図31-6)。 約2年続いたこの実験の間、食糧生産が不十分だったため居住者は結果としてカロリー制限を強いられました。血液検査などによって居住者の健康状態は、予想通り通常の食事をしている"地球人"たちよりも良好と判断されましたが、この短い期間では長期にわたるカロリー制限の老化や寿命に対する影響は分かりません。
なお、Biosphere 2をめぐる後日談として、カロリー制限でヒトは120歳までは生きられるはずだと主張していたWalfordは筋萎縮性側索硬化症のため79歳で世を去り、自ら続けていたヒトのカロリー制限の寿命延長効果を確かめることはできませんでした(ウォルフォード著「人間はどこまで長生きできるか」(PHP研究所、1988)。彼の遺志は共同研究者のRichard Weindruch (UWのアカゲザルカロリー制限研究のリーダー)に引き継がれています(ヴァインドルッヒ「カロリー制限が老化を遅らせる」(拙訳、日経サイエンス1996)p. 36-44、 原著:Scientific American January 1996, Weindruch R “Caloric restriction and aging” pp. 32-38参照)。 億万長者が15億ドルを投じて建設されたという研究施設も食糧だけでなく植物に頼っていた酸素の供給も不十分だったこともあり、現在は閉鎖され観光名所になっているそうです(図31-6)。

最近、カロリー制限に対する関心の高まりを背景に、ヒトに関する研究が行われるようになってきました。 いずれも動物実験ほど長期にわたるものではありませんが、肥満でない人たちを対象に一年から数年以上にわたるもので一般の健常者に関してある程度の情報を与えてくれます。その幾つかを紹介します。
図31-7は、肥満(obese, BMI 30以上)でなく過体重(overweight、BMI=25−30)に分類される平均BMI=27の男女48名を対象にした無作為 (randomized) 研究で被験者を偏りのないようにグループ分けして、それぞれに異なる処方の生活をしてもらい、一年間経って体重と骨密度の変化を調べた結果です。 カロリー制限群では体重減少の大きい人ほど骨密度の低下率が大きかったのに対して運動によって同程度の体重減少を起こした場合は骨密度の低下はほとんどみられなかったという結果でした。
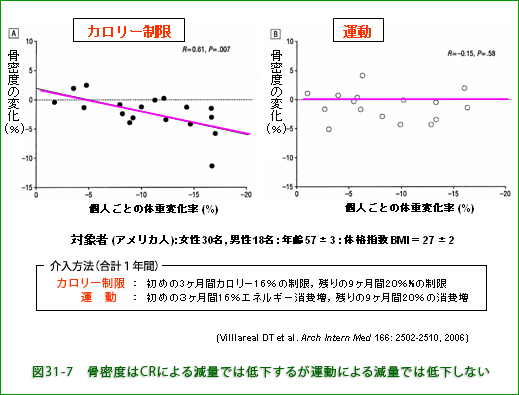
この研究から、運動で体重を減らす場合は骨に対する有害作用はないけれど、カロリー制限の場合は骨が弱くなることが分かります。カロリー制限を何年も続けていると骨粗鬆症の危険が高まることが懸念されます。若い時代の骨量が少ないと後年に骨粗鬆症になりやすいことが分かっていますから、若い女性の過度なダイエットには大いに問題があります。 アンチエイジング目的の安易なカロリー制限は逆に老化を促進し、中高年になって骨折しやすくなりQOL(生活の質)を損ないかねません。
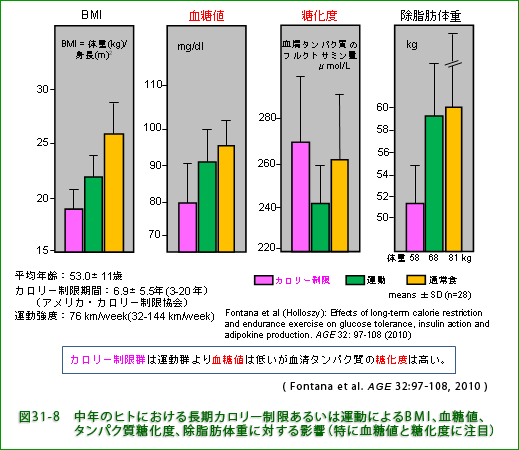
糖尿病の予防や治療には運動がいいといわれています。カロリー制限も血糖値を下げる効果があるので糖尿病に有益だと想像されます。 図31-8 はカロリー制限と運動が中年男性の血糖値(血中のブドウ糖濃度)やタンパク質糖化(タンパク質とブドウ糖の反応)度におよぼす影響を調べた結果です。 BMIは予想されるようにカロリー制限群で大分低く最適値とされる22を大幅に下回っています。 カロリー制限群では血糖値は予想通り低いのですが、注目されるのは、糖毒性(ぶどう糖と反応したタンパク質が細胞・組織の機能劣化などの障害を起こす)の指標である糖化度が血糖値の高い自由摂食群と同程度に高いことです(図31-8 の ![]() と
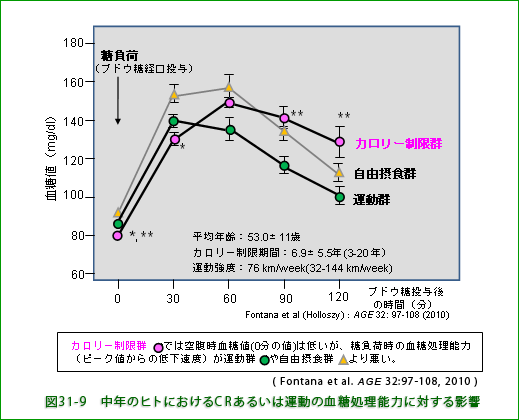
と ![]() の比較)。 カロリー制限群では筋肉量の低下などによって糖毒性を減らす仕組みが影響を受けていることが考えられます。 骨格筋はブドウ糖を取り込んで利用する機能が高く、とりわけ食後高血糖を速く低下させるのに役立っています。実際、実験的に糖を摂取させた(糖負荷した)時の血糖処理能力(血糖値低下の速度)はカロリー制限群では自由摂食群よりも遅くなっています(図31-9、
の比較)。 カロリー制限群では筋肉量の低下などによって糖毒性を減らす仕組みが影響を受けていることが考えられます。 骨格筋はブドウ糖を取り込んで利用する機能が高く、とりわけ食後高血糖を速く低下させるのに役立っています。実際、実験的に糖を摂取させた(糖負荷した)時の血糖処理能力(血糖値低下の速度)はカロリー制限群では自由摂食群よりも遅くなっています(図31-9、![]() と
と ![]() の比較)。
の比較)。
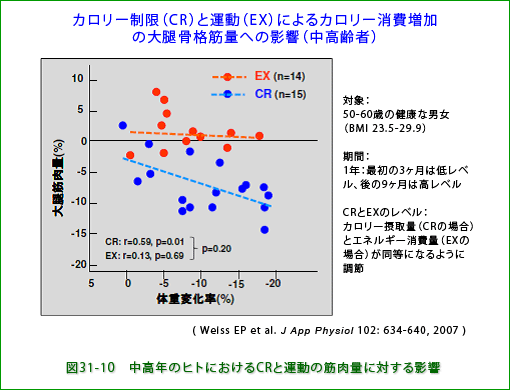
上述のように、骨格筋量をできるだけ多く保つことは、日常生活の上でも血糖値の維持のためにも、たいへん重要です。上述のように(1−3の最後のパラグラフ)実験動物(ラットやアカゲザル)ではカロリー制限によって筋肉量が増加します。ヒトではどうでしょうか。ワシントン大学などの研究グループは、16-18名の50歳-60歳の健康な男女(BMI23.5-29.9)をカロリー制限で体重を減らす群と運動で体重を減らす群に分けて、それぞれの生活をしてもらい一年後に大腿の筋肉量(図31-10)と膝伸展筋力を測定しました。図に示されているように、カロリー制限群では体重減少の程度に応じて明瞭に筋肉量も筋力(図省略)も減少していました。
このような例から分かるように肥満でない人のカロリー制限は骨量や筋肉量が減少し、血糖処理能力の低下などのマイナス作用が起こり得ます。 カロリー制限に動物実験で見られているような有益作用がヒトでもあるとしても(「老化介入・老化制御 - 摂取カロリーと老化 - 食餌制限によるマウスの体重変化」以下の記述)、有害作用の可能性を考えると、運動を組み合わせない限り推奨できる方法ではなさそうです。
3.カロリー制限作用模倣物質(calorie restriction mimetics)
カロリー制限がヒトでも抗老化作用や寿命延長作用があるとしても、厳しい制限を長期にわたって実践するとなると、食べたいものも食べられず空腹を抱えた生活ではQOLが損なわれて、現実的ではありません。 そこでカロリー制限に代わる方法はないかと各種物質が試されています。
有名な赤ワイン成分のレスベラトロール(ポリフェノールの一種)もその一つですが、当初の期待に反して、現在哺乳類で効果が確認されたものはありません(「レスベラトロールresveratrol の”抗老化・寿命延長作用”についての見解」を参照)。その他に、カロリー制限した動物やヒトでは血糖値が下がっているというので、血糖値低下作用のある抗糖尿病薬のメトフォルミンmetformin なども試されましたが、部分的に有効のように見える反面、副作用もありカロリー制限の効用全体を"模倣"出来ませんでした。 カロリー制限や運動のように全身に広範囲にわたる影響がある介入法の一部分を見かけだけ真似をしてもダメというわけです。線虫、ショウジョウバエ、ネズミなどの老化モデル動物の寿命を延ばすことで最近注目されているCR模倣物質としてラパマイシンrapamycinがあります。しかし、この物質は元々免疫抑制剤として臨床的に使われていたもので、当然健常人に使えば免疫系に対する有害作用が懸念されます。またラパマイシンにはタンパク質合成阻害作用があり、特に骨格筋に有害である可能性があります。
かつて、やせ薬として使われたこともある脱共役剤2,4-ジニトロフェノールは、CR模倣物質として検討されたこともありますが、別項でも取り上げたように(「摂取カロリーと老化」“脂肪を燃やす”」参照)毒性が強く使いものになりませんでした。グルコース類似物質2-デオキシグルコースは、エネルギー代謝の解糖系を阻害するので有望視されたこともありましたが、これも毒性が強く役立ちませんでした。
このようにカロリー制限模倣物質は、研究者の長年の努力にもかかわらず、人々の期待に反して使えそうなものはまだ現れていません。カロリー制限の多岐にわたる有益作用を考えると、その働きを一つや二つの副作用のない化学物質で模倣するのは至難の業と言えそうです。本項の中心テーマではないので触れませんが、”運動模倣物質”についても同様です。
![]()
