
小林 芳郎
マクロファージ-死細胞を取り込んだマクロファージの応答-
私たちの研究 (3) -個体レベル-
さて先に述べたBBRC(239, 799-803, 1997)への発表のあと、直ちに私はこの発見の生体内での意義をさぐるために (1) 放射線全身照射モデル、(2) アポトーシス細胞をマウス腹腔に投与するモデル、(3) Con A肝炎、の3つのモデル、さらに後になって(4)癌化学療法剤あるいは放射線照射でアポトーシスを起こした細胞を免疫してキラーT細胞を誘導するモデル、を手がけようと決めた。なお適度の放射線を全身照射すると、胸腺や脾臓や骨髄など免疫系の組織にアポトーシスを誘導することが知られているし、Con Aをマウスに静注すると、T細胞やNK細胞の活性化を介して急激に肝実質細胞にアポトーシスが誘導されて肝炎が起こることが知られている。またさらに今から4年ほど前、5番目の系として、(5)性周期に伴って生殖器に浸潤する好中球のアポトーシスとその後の応答、を調べることにした。
 (1) 放射線全身照射モデル
(1) 放射線全身照射モデル

EUは放射線医学総合研究所と共同で放射線全身照射に伴う胸腺のアポトーシスと好中球浸潤を調べ始めた。すると期待通り好中球が胸腺に一過的に浸潤したのである(→J Leukoc Biol.67, 780-784, 2000)。好中球浸潤の組織写真は雑誌の表紙を飾った。今も私たちの研究室の外の廊下に飾ってある。
私たちがJ Leukoc Biolに発表したあと、英国のグループが、放射線全身照射が脾臓マクロファージの活性化をもたらすことを報告した(Oncogene 20, 7085-7095, 2001)。
EUはこれらの業績によって1999年3月理学博士の学位を取得した。
その後、浸潤する好中球の役割について2人のTUが調べ、興味深い結果を得た。
そのひとつ、好中球が胸腺の回復に関わるという結果については、その後ENが詳しく検討して、好中球とストロマ細胞の相互作用によってSDF1産生が高まることがそのおもな機構であることを見出した。これは現在投稿準備中である。
やがてTIが、MIP-2やその受容体CXCR2に対する抗体を取得して、その効果をアポトーシス細胞をマウス腹腔に投与するモデルで明らかにしたあと(→Apoptosis 9, 485-493, 2004; 後述)、放射線全身照射モデルでの好中球浸潤とその意義について調べることになった。
B10マウスに放射線照射(1Gy)すると胸腺への好中球浸潤は12時間目にピークとなり、この好中球浸潤は抗MIP-2抗体や抗CXCR2抗体で有意に抑制された。さらに放射線照射後アポトーシス細胞を貪食している時期の胸腺マクロファージを取り出すとMIP-2を産生したが、放射線照射直後に取り出した胸腺マクロファージはMIP-2を産生しなかった。以上より、放射線全身照射モデルは、私たちの見いだした試験管内での「アポトーシス細胞の取り込みに伴うマクロファージの応答」を個体で観察するのにとてもすぐれたモデルであるといえる。
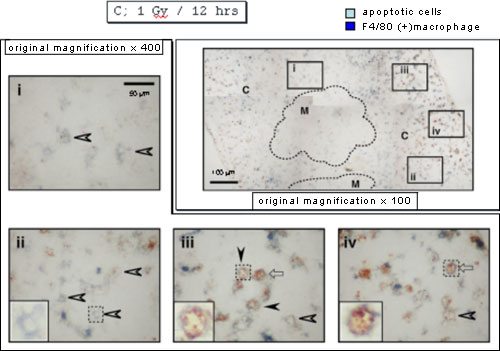
さてアポトーシス細胞を抗ssDNA抗体で(茶色)、マクロファージを抗F4/80抗体で(青色)それぞれ染色すると、放射線照射9時間目では、皮質(下図、C)の被膜直下(下図、iii)に両方の抗体で染色される、つまりアポトーシス細胞を貪食したマクロファージが検出されたが、その他の領域では両者は別々に検出された。
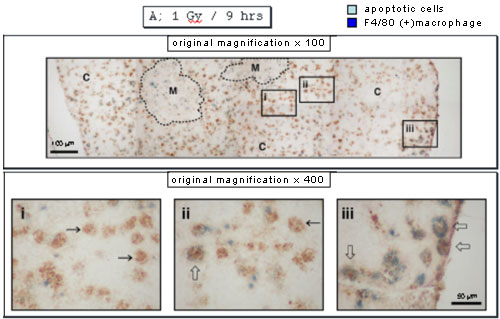
ところが照射12時間目になると(下図)、ほとんどのアポトーシス細胞が消失し、iiのように中が空洞に見えるマクロファージ(おそらく消化が終了したのであろう)や、iii やivのように中にアポトーシス細胞を数個保持したマクロファージ(おそらくまだ消化が終了していないのであろう)が検出された。興味深いことに、中が空洞のマクロファージは皮質の深い部分(髄質に近い部分)に多く検出された。
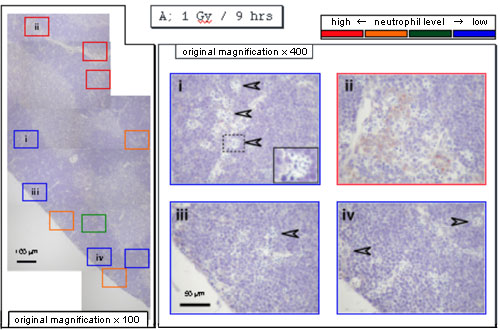
一方、好中球を抗ミエロペルオキシダーゼ抗体で染色すると、放射線照射9時間目には血管の周囲におもに検出された(下図)。
それに対し、放射線照射12時間目では皮質の被膜直下に検出された(好中球は移動していた!)。このとき先の結果と一致して、中が空洞の細胞(iii)や中に(アポトーシス)細胞を数個含んだ細胞(ii)が検出された。
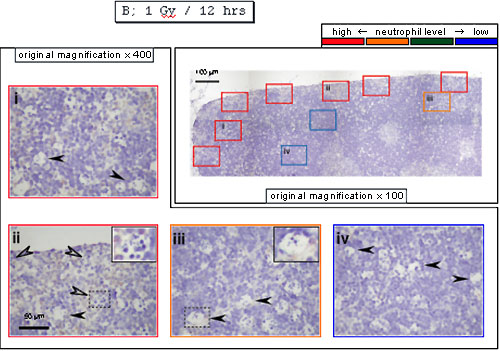
以上から、好中球が移動するにつれアポトーシス細胞の消化が進んでいるように思われた。これを支持して、抗MIP-2抗体で処理して好中球の浸潤を抑制すると、放射線照射12時間目でも、上のiiのような細胞が多数見られ、消化が抑制されているように見えた。さらに、好中球がアポトーシス細胞のマクロファージ内での消化を助けているという結果は試験管内でも観察された(→J Immunol 175,3475-3483,2005)。TIはこれらの業績により2005年3月理学博士の学位を取得した。後に別の研究者らによって、Mincleという分子がここでの死細胞の認識に関わっていることが示された(Nat Immunol. 9, 1179-1188, 2008)。
上のiiのような“クラスター”はアポトーシス細胞が貪食されている状態を示すと考えられる。ここでの胸腺には、F4/80陽性の常在性マクロファージの他、F4/80陰性の常在性マクロファージ、浸潤した単球、単球が分化したマクロファージ、好酸球なども存在していて、どれがアポトーシス細胞の貪食除去に関わっているかは未解決の重要な課題である。
このように放射線全身照射モデルは、アポトーシス細胞が急激かつ大量に現れたときの生体の応答を調べるのに大変適していた。そこでTSはほとんど後期アポトーシスが検出できない照射条件(0.75 Gy)を探し、その条件下でiNOS欠損マウスを用いてNOの抗炎症作用を明らかにしようとした。
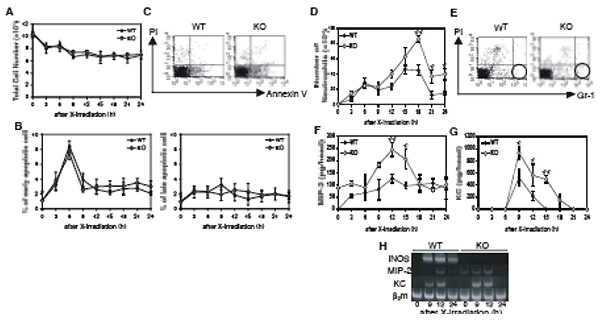
結果、iNOS欠損マウスは野生型マウスとアポトーシスの頻度は変わらない(上図B)のに、好中球が多く浸潤し(D)、MIP-2(F、H)やKC(G、H)はタンパクレベルでもmRNAレベルでも多く発現した。同じ結果が野生型マウスにNOSの阻害剤(L-NAME)を投与しても得られている。またこの条件ではTGF-β とIL-10のmRNAは胸腺中に検出されていない。これらの結果は、NOがアポトーシス細胞の除去に伴い好中球の浸潤が起こることがないようにしていることをin vivoで明らかに示したものである。これはJ Immunolのcutting edgeに採択された(→J Immunol 179, 3407-3411, 2007)。なおTGF-βがin vivoで同様の機能を果たしていることは、LPS誘導性肺炎症モデルでアポトーシス細胞を投与することにより明らかにされている(J Clin Invest 109, 41-50, 2002)ものの、今回の結果はより生理的な条件で、外からアポトーシス細胞を加えることなく示したという点で、特筆される。TSはこれらの業績により最近日本学術振興会のDC2に採用され、2009年3月理学博士の学位を取得した。
最近HFはIL-10欠損マウスを用いて放射線全身照射モデルの解析を行った。結果、野生型では放射線(1 Gy)照射に伴ってIL-10が誘導されたが(これは上の結果と異なるが用いた線量によるのであろう)、好中球の浸潤やMIP-2やKC産生がIL-10の欠損によって増えることはなかった(→BBRC 369, 432-436, 2008)。これらから、IL-10は放射線全身照射モデルにおける好中球浸潤に関わっていないと考えている。
 (2) アポトーシス細胞をマウス腹腔に投与するモデル
(2) アポトーシス細胞をマウス腹腔に投与するモデル
RMは、あらかじめチオグリコレート培地を投与して無菌的腹腔炎を起こしマクロファージを集積させておいたマウスを用いて、後期アポトーシス細胞(ひとによっては2次的ネクローシスともよぶ)をマウス腹腔に投与したときの好中球浸潤を調べた。結果、経時的に好中球が浸潤し、MIP-2が検出された。一方リポソーム封入クロドロネート(![]() *1)でマクロファージを枯渇しておくと浸潤とMIP-2産生が抑制された(→Apoptosis 6, 411-417, 2001)。
*1)でマクロファージを枯渇しておくと浸潤とMIP-2産生が抑制された(→Apoptosis 6, 411-417, 2001)。
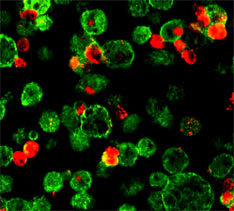
一方CKとKKは別の後期アポトーシス細胞を用いて、無菌的腹腔炎を起こしておいたマウスだけでなく正常のマウスでも同様に好中球が浸潤し、MIP-2が産生されることを見いだした。さらに腹腔内で後期アポトーシス細胞を取り込んでいるマクロファージをcell sorterでわけ、それがMIP-2を産生することを示した(左写真)(→BBA 1541, 221-230, 2001)。
先にも述べたようにTIは抗MIP-2抗体と抗CXCR2抗体を作成してその特異性を明らかにしたあと、あらかじめチオグリコレート培地を投与して無菌的腹腔炎を起こしマクロファージを集積させておいたマウスを用いて、後期アポトーシス細胞(ひとによっては2次的ネクローシスともよぶ)をマウス腹腔に投与したときの好中球浸潤に対する効果を調べた。結果、正常細胞投与による好中球浸潤レベルまで抑制され、この好中球浸潤がMIP-2とCXCR2とに媒介されていることを明らかにした(→Apoptosis 9, 485-493, 2004)。
その後NTは後期アポトーシス細胞のかわりに3回凍結融解して得たネクローシス細胞を用いて、正常マウスに無菌的腹腔炎を起こし、その好中球浸潤を調べた。結果、後期アポトーシス細胞に比べ多量のKCが産生され、抗KC抗体が抗MIP-2抗体と同程度にまで部分的に好中球浸潤を抑制した。おそらくKCとMIP-2は相乗的に作用しているのであろう(→BBRC 361, 533-536, 2007)。後期アポトーシス細胞とネクローシス細胞とで浸潤する好中球にどのような機能的差異があるのかは今後の課題である。
 (3) Con A肝炎
(3) Con A肝炎
この肝炎モデルではT細胞やNK細胞が活性化されて肝実質細胞の傷害(アポトーシス)が起こるとされていて、ウイルス肝炎や自己免疫性肝炎のモデルとして広く研究されている。一方、エンドトキシン/ガラクトサミン肝炎では、肝実質細胞のTNF-αによって起こるアポトーシスが引き金となって好中球が浸潤し、最終的に組織傷害(ネクローシス)がもたらされる(J Immunol 160, 3480-3486, 1998)。そこで私たちはCon A肝炎でもアポトーシスが引き金となって好中球が浸潤し、組織傷害が起こるのではないかと考えた。
TOは抗Gr-1抗体で好中球を枯渇するとCon A肝炎が著しく抑制されることを見いだした。その後SHはこのときIFN-γ産生も著しく抑制されること、IFN-γはおもにTやNK細胞によって産生されること、好中球がそれを助けていることを見いだした(→Cell Immunol 233, 23-29, 2005)。
しかし予想に反し、アポトーシスをカスパーゼ阻害剤(Z-VAD-fmk)抑制しても好中球の浸潤が見られた。さらにMHはリポソーム封入クロドロネート*でマクロファージを枯渇して、Con A肝炎に対する効果を調べたところ、アポトーシス細胞が処理されずに増えるのではなく、むしろ著しく減少した(→Cell Immunol 251, 25-30, 2008)。しかし一方でMIP-2やKC産生は低下し、好中球の浸潤も減少した。したがって現在のところ、アポトーシス細胞を取り込んだKupffer細胞がMIP-2あるいはKCを産生して好中球をよぶのではなく、おそらくCon Aで刺激されたTまたはNK細胞がマクロファージ依存的にこれらケモカインを産生するのであろうと考えている。いずれにしろ現在では、本モデルはアポトーシスに伴う応答を調べるにはあまり適当ではないと考えている。
 (4)癌化学療法剤あるいは放射線照射でアポトーシスを起こした細胞を免疫してキラーT細胞を誘導するモデル
(4)癌化学療法剤あるいは放射線照射でアポトーシスを起こした細胞を免疫してキラーT細胞を誘導するモデル
YSは、アポトーシスP388 (DBA/2マウス由来) 細胞を系統の異なるC57BL/6マウス腹腔に投与するとアロキラーT細胞が腹腔中に検出されるようになることを認めた。そこでYSはこの応答の初期に腹腔に浸潤する細胞のうち好中球の役割を調べた。好中球を抗Gr-1抗体で枯渇したり、好中球浸潤を抗MIP-2抗体で抑制すると、MCP-1産生が抑制され、それによってキラーT細胞の浸潤、活性が抑制された(→J Leukoc Biol 81, 412-420, 2007)。好中球は自らMCP-1を産生しているわけではなく、他のMCP-1産生細胞に作用して助けているらしい(投稿準備中)。YSはこれらの業績により2007年3月に理学博士の学位を取得した。
MTは、放射線照射したP388細胞を同型のCDF1マウス腹腔に投与したとき、P388細胞を所属リンパ節(傍胸腺リンパ節)、脾臓へと運搬する細胞を詳しく調べ、未熟樹状細胞ではなく、浸潤した好中球と単球が運搬することを見いだした(→BBRC 377, 589-594, 2008)。この条件で特異的キラーT細胞が誘導されているとの確証は得られていないが、浸潤好中球が(アポトーシス)癌細胞を取り込んで所属リンパ節に移動することを初めて示した点で、重要である。MTはこれらの業績により2008年3月に理学博士の学位を取得した。
 (5)性周期に伴って生殖器に浸潤する好中球のアポトーシスとその後の応答
(5)性周期に伴って生殖器に浸潤する好中球のアポトーシスとその後の応答
SSは性周期に伴って生殖器に浸潤する好中球がアポトーシスを起こしているか、起こしている場合マクロファージに貪食除去されるか、その後の応答は何か等を明らかにしようとした。 好中球はおもにMIP-2によって生殖器に集められ、metestrus期に膣に放出される。この好中球は膣内常在菌を殺菌していると予想されたので、まず抗Gr-1抗体によって好中球を枯渇した。 Gr-1抗原は、好中球に強く発現しているが、好酸球にも弱く発現している。しかし調べた限りでは生殖器内に浸潤する好中球のみ枯渇されていた。結果、予想通り、膣内常在菌は好中球の除去により増大した。 一方、膣内に放出された好中球は、一部アポトーシスを起こしていたが、一部はそうでなかった。この原因は不明であるものの、殺菌以外の機能を予想させた。 驚くべきことに、好中球を枯渇すると性周期がdiestrus期で停止し、エストラジオール、プロゲステロンのレベルに影響があった(→BBRC 382, 35-40, 2009)。 好中球はおそらくオピオイドペプチドの放出を介して性周期を維持しているようである(投稿中)。SSはこれらの業績により2009年4月に理学博士の学位を取得した。
![]()