 |
東邦大学名誉教授 横山 祐作 |
 麦角アルカロイドの全合成
麦角アルカロイドの全合成  無保護アミノ酸の官能基選択性
無保護アミノ酸の官能基選択性  アミノ酸のラセミ化
アミノ酸のラセミ化
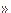 芳香族アミノ酸のブロム化
芳香族アミノ酸のブロム化  新赤堀反応
新赤堀反応  IDO阻害剤の開発
IDO阻害剤の開発
アミノ酸の化学−芳香族アミノ酸のブロム化
『無保護アミノ酸の特徴として、液性を変えることによってアミノ基、カルボキシル基のイオン化の状態を変化させることが出来る。従って、反応性もコントロール出来るはずである。』
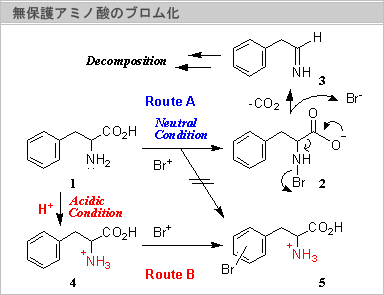
フェニルアラニン(1)のベンゼン環を直接ブロム化しようとすると、反応種であるBr+は、より反応性の高いアミノ基を攻撃する。すなわち、中性あるいは塩基性条件下ではアミノ基の孤立電子対がBr+と反応し2となってしまう。その結果、Br原子はアミノ基の電子を奪いBr-として脱離しようとする。すなわち、ブロム化剤は酸化的性質を示す。それが引き金となってカルボキシル基は容易に脱炭酸し、それに続く加水分解や種々の分解反応を起こすことが知られている(右図上,Route A)。
しかし、強酸性中では、アミノ基はアンモニウム塩(4)として存在するので、アミノ基の求核性はなくなり、Br+とは反応性しなくなり、芳香環へのブロム化が進行し、ブロム体(5)が得られるはずである(右図上,Route B)。
この様な作業仮説に従って、強酸性中(60%硫酸)でのブロム化を試みた。
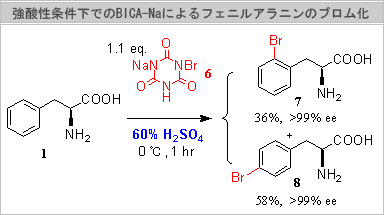
ブロム化剤として強酸性水溶液中でも用いることのできるブロモイソシアヌル酸ナトリウム(BICA-Na,
6)を用いてPhenylalanine (1)
をブロム化したところ、期待したとおりモノブロム体がオルト体(7)35%とパラ体(8)62%の混合物として得られた。生成物7と8の合計収率は、94%と高収率で得られた(右図下)。
この様に、「無保護アミノ酸は、そのpHを変えるだけで反応性をコントロール出来る」ということを示したことは、無保護アミノ酸の反応を開発する上で、非常に大きな意味を持つと考えられる。
参考文献:Y.Yokoyama, T.Yamaguchi, M.Sato, E.Kobayashi, Y.Murakami, H.Okuno, Chem. Pahrm. Bull., 54, 1715-1719 (2006).

