単一細胞または細胞膜切片を用いたチャネルの解析
興奮性細胞でどのような電気活動が起こっているかは、当初巨大神経細胞を用いて詳細な検討が行われ、その際に膜電位固定法という巧妙な方法が用いられました。この解析によって得られた結果が原則的には各種の興奮性細胞に適用されたのですが、個々の細胞によって異なる点も多くそれらを個別に研究する必要がありました。しかし、実際の細胞は小さく、同じ方法を用いることは不可能でした。
そこでやむを得ず微小電極で得られた結果から間接的に推測するか、あるいは組織標本そのままで膜電位固定法を行うかしか方法がありませんでした。
ところが、1970年代中頃に画期的な方法、ホールセルクランプ及びパッチクランプ法が開発され、心筋や平滑筋などでこの方法を用いた解析が活発に行われるようになり、このパッチクランプ法は現在も最も進んだ手段としてさかんに用いられています。
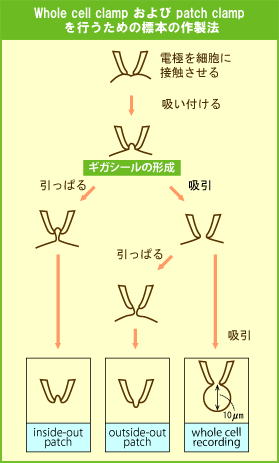
パッチクランプを行うための標本作製
- コラゲナーゼ等で結合組織を分解し単一の細胞を得る。
- 微小電極よりも先端の径の大きい電極を左図のように細胞に接触させ少し吸引して密着させる。
これにより電極と細胞膜との間に極めて密接な結合が形成される。これをギガシールと呼ぶ。(抵抗がギガオームの単位の接着ができるということ) - 目的に応じて次のような標本を作製する。
「whole cell recording」
吸引により細胞膜に穴を開け細胞内と電極内の液とが導通し、細胞が電極の先端にぶら下がったような標本とする。この状態で実験することを whole cell recording という。
「inside−out patch / outside−out patch」
電極を引っ張ることによって細胞膜を引きちぎり、電極の先端に細胞膜の一部が張り付いた形の標本を作るもので、この場合もともと細胞膜の内側であった面が外を向いている状態と(inside-out)と内側を向いている状態(outside-out)を作ることができる。
これらのいずれかの標本を作製して膜電位固定法を適用します。
膜電位固定法
上記の方法を各種の工夫を加えながら適用すると、単一のチャネルを通る電流を直接測定することが可能となり、チャネルに関する研究が飛躍的に発展しました。
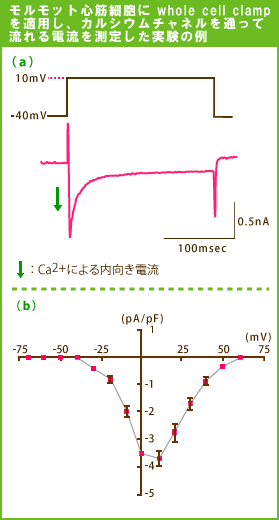
心筋は恐らく最も多くこの方法が適用されている興奮性細胞です。次にこの方法でCa2+電流を測定した例を示します。(左図参照)
(a)
膜電位固定をする前の電位(保持電位 holding potential)を−40mVとすることによってNa+電流を不活性化し、電圧を+10mVに固定すると上図のような電流が流れます。下向きのふれがCa2+による内向き電流を示しています。
(b)
(a)に示した実験で固定する電位をさまざまに変化させ流れる電流を測定し、横軸に固定した電位をプロットしそれぞれの電位でどれだけの電流が流れるかを縦軸にプロットしたもの(これを”電流−電圧曲線 I−V
curve”と呼ぶ)。
縦軸は下向きが内向きの電流、上向きが外向きの電流を表しますが、Ca2+電流を測定する条件で行うと内向き電流のみが流れます。
+10mV近辺で内向きCa2+電流が最大となっていることがわかります。すなわち、この電位でCa2+チャネルが最も活性化されることを示しています。
