 |
東邦大学名誉教授 横山 祐作 |
 構造決定
構造決定  保護基
保護基  Heck反応
Heck反応  無保護アミノ酸
無保護アミノ酸 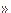 光学純度
光学純度
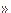 ブロム化剤
ブロム化剤  赤堀四郎
赤堀四郎 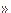 アミノアルコール
アミノアルコール 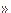 IDO
IDO
もっと有機化学
構造決定
目で見ることが出来ない有機化合物の構造を、どうして決めることが出来るのでしょうか?
通常は、赤外吸収スペクトル(IR)、質量スペクトル(MASS)、核磁気共鳴(NMR)スペクトルなどの測定を行って構造を決めます。下にフェナセチンという医薬品のスペクトルの例を示しています。このスペクトルを見ても、フェナセチンの構造式がすぐに分かるわけではありません。膨大な数のスペクトルの測定から得られた法則を駆使して、構造を決めたい化合物のスペクトルのパターンを詳細に解析することにより、分子の構造をパズルを解いていくように想像していきます。従って、有機化学の実験をすると言うことは、頭をとても柔らかくして想像力を豊かにする必要があります。
保護基
ここで、保護基の役割を理解しやすいように、アミノ酸が2つ結合したジペプチドの合成を例に挙げて説明します。この反応は、生体内でタンパク質が作られるときも起こっている反応です。合成化学(試験管内)の反応と生体内の反応(生合成)とを比較して、どれだけ生命がうまく反応しているかも感じ取ってください。
ジペプチドの合成は、異なったアミノ酸(1,2)のアミノ基とカルボキシル基が結合(カップリング)して、アミド結合を形成する反応です(右図上)。もし、保護していないアミノ酸同士のカップリング反応をした場合には、4種の異性体(3-6)の混合物となってしまい、目的のジペプチド(ここでは3)だけを得ることはできません。生合成では、RNAやタンパク質合成酵素の働きで、ただ一種類のジペプチド(例えば3)を合成しています。すなわち、細胞内のタンパク質合成では、保護しなくても目的のカップリングだけを起こすことが出来るというわけです。
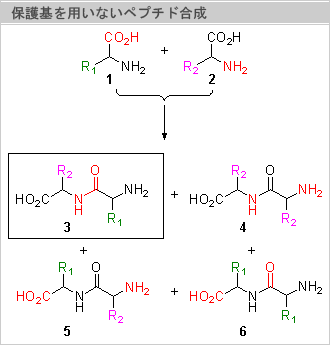
ところが化学合成(右図下)では、無保護アミノ酸を用いたペプチド合成でただ一種類だけのジペプチド(ここでは3)を得ようとすると、反応させたくないアミノ基とカルボキシル基が反応しないようにブロックしなければなりません。このことを、保護するといいます。保護基を用いてジペプチド(3)を合成しようとすると、アミノ基の保護[A]、カルボキシル基の保護[B]、カップリング[C]、脱保護[D]の4行程が必要になってしまいます。
Heck反応(Heck reaction)
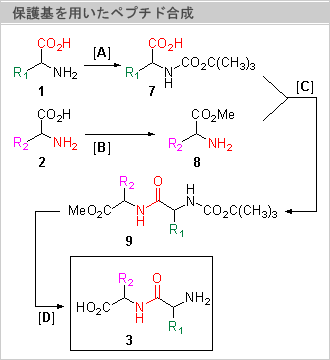
パラジウム錯体Pd(0)を触媒として芳香族ハロゲン化物(1)でアルケン(2)の水素を置換する反応で、置換オレフィン(3)をつくる反応。通常は、フォスフィンリガンドを必要とするが、収率も高く、官能基選択性にすぐれている。
反応機構
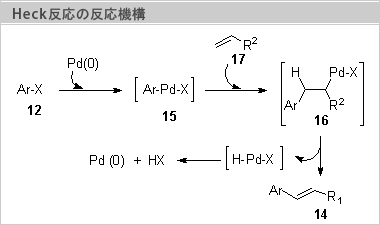
0価のPdが芳香族ハロゲン化物(12)に酸化的付加しσ錯体(15)を生じる。σ錯体(15)がオレフィン(17)の二重結合に対して挿入反応した16を生ずる。パラジウムはそれが結合している炭素の、隣りの炭素上の水素とともにシン-β脱離して生成物(14)を与える。ヒドリドパラジウム錯体(H-Pd-X)からハロゲン化水素が還元的脱離して触媒が再生される。通常はここで副生するハロゲン化水素をトラップするために3級アミンや炭酸カリウムのような塩基が添加される。
詳細は下記サイトを参照してください。(新しいウィンドウで表示します)
 参考ページ http://www.chem-station.com/odoos/data/x-ene-1.htm
参考ページ http://www.chem-station.com/odoos/data/x-ene-1.htm
 『化学ポータルサイト Chem-Station』トップページ http://www.chem-station.com/index.htm
『化学ポータルサイト Chem-Station』トップページ http://www.chem-station.com/index.htm
無保護アミノ酸
Zwitter Ion型であることの重要性
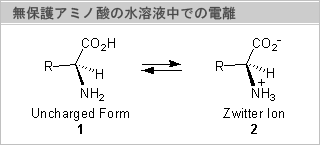
無保護アミノ酸は、酸であるカルボン酸と塩基であるアミノ基を有しているため、分子内で塩を作り、Zwitter Ion型(2)となっていて、高度に分極している。このため、アミノ酸は無機物と同じで、水には溶けるが有機溶媒にはほとんど溶けない。従って、有機溶媒を用いた反応が進行しなかったり、分離・精製が困難であったりと、無保護アミノ酸を合成原料として用いる際の大きな障害となっている。しかし、一方では有機反応を行う際のアミノ酸特有の性質を示す原因ともなっている。
アミノ酸は水溶液中でほぼ100%の確率でZwitter Ion(2)型となっているが、DMSOのような極性有機溶媒中ではZwitter
Ion型(右図)でなく、一部解離していない形(1)で溶解していることが知られている。水溶液中でのアミノ酸がZwitter
Ion型であるということが安定性を論じる際に重要ではないかと考えている。また、無保護アミノ酸が水溶液で特に安定であるという事実は、今後無保護アミノ酸の班のを開発していく上で重要な知見であると考えている。
光学純度
鏡像体過剰率(enantiomeric excess)ともいう。ラセミ体とエナンチオマーの比を百分率(ee)で表す。
例えばS-体10%とR-体が90%の時には、RS-体(ラセミ体)は20%であるから、光学純度(鏡像体過剰率)は80%eeである。
ブロム化剤
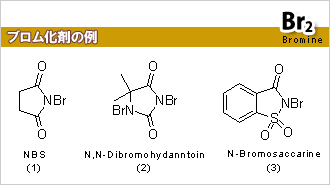
芳香環のブロム化は、親電子置換反応である。従って、Br+を発生する試薬を使う必要がある。また、Br+は容易に2個電子を取り込んでBr-となりやすい。即ち、ブロム化剤は酸化剤としての性質も有する。ブロム化剤として代表的なものはBr2であるが、有毒である上、液体で揮発しやすいため、非常に危険で取り扱いにくい。従って、取り扱いが容易である多くのブロム化剤が開発されている。右図に示したブロム化剤(1)・(2)・(3)は、いずれも固体で、取り扱いが容易であるが、Br+を発生しやすい性質を持っているため、酸化剤としての性質もある。
赤堀四郎
- 1921年 千葉医学専門学校薬学科(現千葉大薬学部)卒業
- 1939年 大阪大学理学部化学科教授
- 1958年 阪大タンパク質研究所初代所長
- 1960年 大阪大学第7代総長
- 1965年 文化勲章受章
 赤堀四郎(あかほり しろう) (1900−1992年 )
赤堀四郎(あかほり しろう) (1900−1992年 )
- 醤油の香気成分から多数のアミノ酸を合成。
- ヒドラジン分解法を考案し、タンパク質の構造解析を飛躍的に発展させる。
- 「蛋白質を構成するアミノ酸の結合状態に関する研究」を発表し、学士院賞を受賞。
経歴に示すように、非常に著名なアミノ酸、タンパク質研究の第一人者である。
赤堀反応を発表した年(1943年)は太平洋戦争の時代であり、研究環境が劣悪だったにもかかわらず、独創的な研究を発表していることは尊敬に値する。
写真: ファルマシアvol.29 (No.3), 323ページ(1993) より引用改編
アミノアルコール
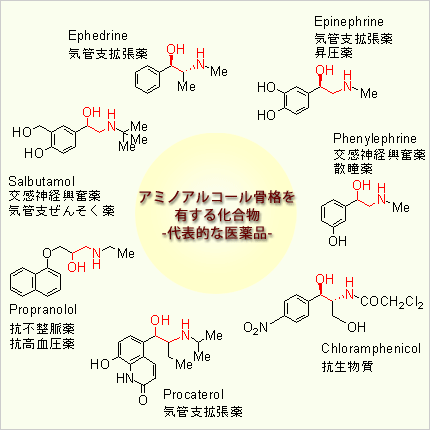
アミノアルコールは下の構造式中に赤色で示した部分構造である。下に示した化合物はいずれも、医薬品として重要なものばかりである。アミノアルコールを部分構造として有する化合物は、医薬品以外にも天然物、その他の生理活性物質に多く含まれる。従って、この部分構造を有する一般合成法の開発は非常に重要である。
インドール 2,3-ジオキシゲナーゼ(Indole 2,3-Dioxygenase, IDO)
今、強力なIDO阻害活性物質の開発が望まれている
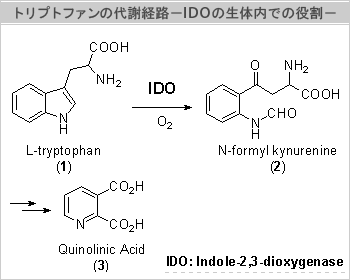
酵素の一種であるIndole-2,3dioxygenase(IDO)は、生体内におけるトリプトファン代謝の主要経路であるKynurenine経路の初期反応を触媒するトリプトファン分解酵素である(右図)。トリプトファンは、生体の防御機能である免疫反応を司るT-細胞が働くためには必須のアミノ酸である。従って、この酵素が活発化すると、トリプトファンが不足し免疫機能が低下する。例えば、妊娠すると、子宮の周辺ではこの酵素が異常に多く発現し、免疫反応を抑えて流産するのを防ぐのである。しかし、一方でガン細胞(特に子宮癌)は、この酵素の活性を異常に高め、免疫反応(ガン細胞が分解されること)を防いでいるのである。
また、この酵素は、アルツハイマー病患者の脳内でも強く発現していることがわかってきた。IDOの中間代謝産物であるN-Formylkynurenine(2)から、さらに代謝されて生ずるQuinolinic Acid(3)が、アルツハイマー病における痴呆症の発症に深く関与していることも明らかにされつつある。
すなわち、IDOを阻害することがこれらの疾患の予防や治療に有効であると期待されており、よいIDO阻害剤を見つけることが出来れば、今までとは全く異なった作用機序による抗癌剤や、アルツハイマー治療薬の開発が可能になると考えられ、強力なIDO阻害活性物質の開発が望まれている。